高唾液酸蛋白的 IEX 糖譜分析,助您獲得更準確分析結果
糖基化作為非基因模板的酶促修飾反應,具有異質性等特點。隨著中國藥典 2020 年版對糖基化重要性的提出,因糖基化對藥物特性有顯著影響,所以控制糖基化以保障藥物的安全、有效、質量可控是十分有必要的。
目前已上市的蛋白藥物中糖蛋白藥物占比大于 2/3。糖基化分析可以從完整糖蛋白水平、糖肽水平、游離寡糖水平和單糖水平進行。目前最常用的 HILIC-FLD/MS 同時也非常適合作為單抗 N-糖譜分析;傳統 N-糖標記使用 2-AB 試劑,不過該方案仍有一些可以提升的空間:諸如前處理時間較長、質譜鑒定時靈敏度不夠等。因此,一些搭配新型標記物的前處理試劑盒(如 Gly-X InstantPC )正在慢慢被市場所接受。
還在把大量時間扔給 N-糖前處理嘛?聽說最頂尖的實驗室都用它
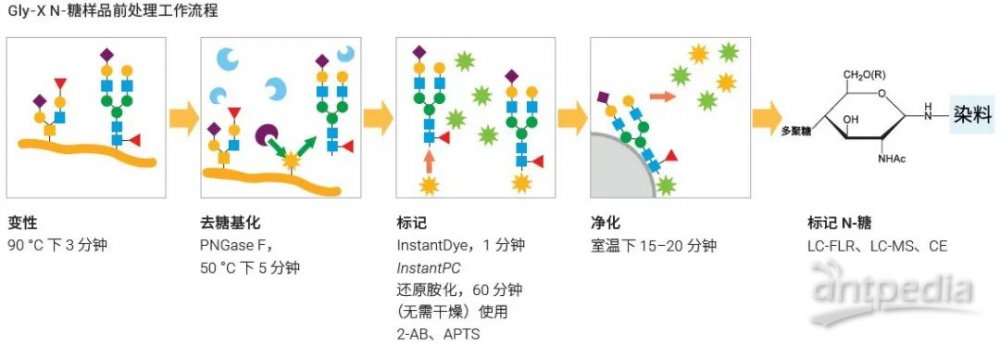
圖 1. Gly-X N-糖樣品前處理工作流程。推薦的初始樣品量為 1-40 μg,最大樣品量高于類似工作流程。可能還可使用更多蛋白質,具體取決于分子。如需了解更多的樣品考慮因素,請參閱具體的 Gly-X 產品手冊
對于融合蛋白等唾液酸含量較高的糖型,HILIC-FLD/MS 法仍存在一定的不便:譜圖過于復雜且無法獲得合適的分離,因此 QC 放行標準難以確定。
圖 2. 用 HILIC-FLD 法分析 InstantPC 標記的 EPO 游離 N-糖(上圖:優化的梯度方法;下圖:N-糖譜常規方法)
基于以上的問題,安捷倫參考中國藥典 2020 年版三部中康柏西普注射液的糖譜分析法。對 EPO、FSH 和融合蛋白 3 種高唾液酸糖蛋白進行 N-糖譜表征:使用更高熒光響應的 InstantPC 快速標記游離 N-糖,依靠不同數量的唾液酸帶電荷數不同在強陰離子交換(SAX)色譜上進行分離。

圖 3. 采用離子交換色譜法分析高唾液酸蛋白 N 糖譜(樣品從上到下分別是:EPO, FSH, 融合蛋白,IPC 標記的唾液酸標準品。唾液酸標準品洗脫順序從早到晚依次是:NA4;NA4S1;NA4S2;NA4S3;A4)
對比 2020 年版中國藥典中傳統 2-AB 法的 Z 值, IPC 標記 Z 值落在同一區間內。通過對融合蛋白游離寡糖連續 6 針進樣比對,可以發現該液相方法良好的重現性。
圖 4. 融合蛋白連續 6 針進樣疊加譜圖
離子交換色譜方法
儀器: Agilent 1260 HPLC system with binary pump
色譜柱: Agilent Bio SAX, 4.6x250mm, NP5, PEEK, PN 5190-2467
流動相 A: Tris HCl buffer 10mM, pH 8.5
流動相 B: 流動相A+ 500mM NaCl
梯度運行
檢測器 FLD
流速 0.6mL/min
總結
本文介紹了一種全新的高唾液酸化蛋白的 N-糖表征方法。使用 Gly-X 平臺,可以簡單快速地進行 N-糖前處理,搭配 InstantPC 染料,可以獲得足夠的熒光響應。與 HILIC-FLD 法不同,SAX 法表征的高唾液酸蛋白圖譜簡單,方法重現性良好,更易被常規 QC 中 UV 檢測所接受。
文末福利
金秋促銷來襲,如果您對安捷倫 Gly-X 樣品前處理包感興趣,請咨詢小程序客服了解最新促銷信息~
版權所有,違者必究。如需轉載,請與工作人員聯系。