熱點應(yīng)用丨ATR-FTIR技術(shù)在生物液體--人類血清白蛋白研究中的應(yīng)用
衰減全反射傅里葉變換紅外光譜(ATR-FTIR)是分析生物流體的一種理想技術(shù)。紅外光譜記錄分子鍵振動,可以獲得生物樣品的紅外指紋圖譜。醫(yī)療保健研究人員和臨床醫(yī)生關(guān)注“液體活檢”(一種微創(chuàng)的樣本收集方法)。許多生物液體,如尿液、唾液和血液,可以使用ATR-FTIR進行研究。利用生物液體樣品之間的光譜差異,可以區(qū)分健康患者和患病患者。
血液是醫(yī)學(xué)診斷中應(yīng)用最廣泛的生物液體,它由血漿、紅細胞、白細胞和血小板組成。對于光譜分析,通常使用血漿或血清,因為這兩種液體可以冷凍保存。血液的冷凍過程會導(dǎo)致細胞破壞,血紅蛋白對光譜信號影響很大。血漿是在抗凝管中離心分離的水溶液,而血清是通過血液凝固分離血細胞和血小板得到的,如圖1。血清更常用,因為血清的制備方法可以有效地去除紅細胞。
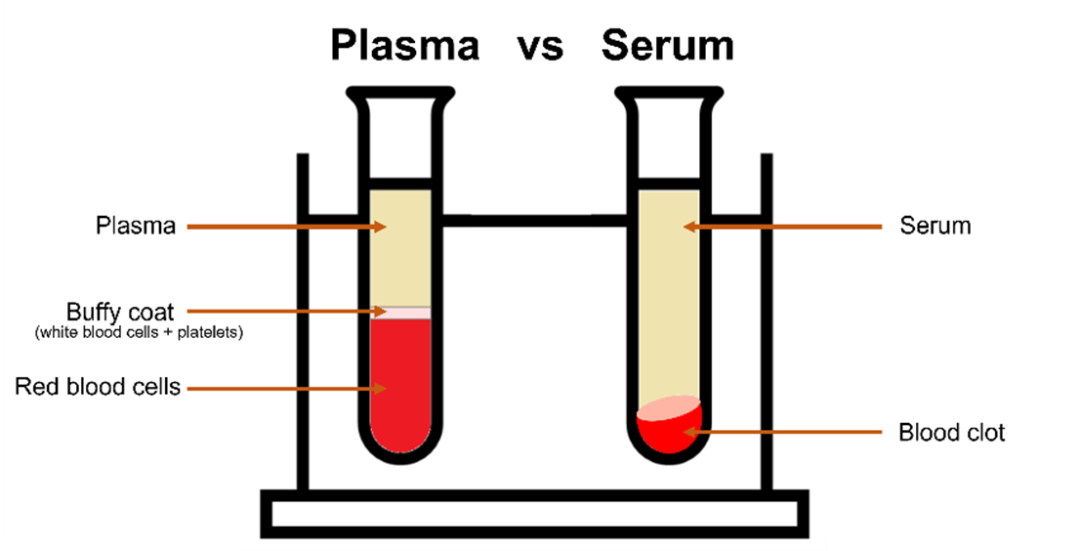
圖1 血漿和血清
ATR-FTIR技術(shù)在中紅外區(qū)域(4000cm-1~400cm-1)檢測生物樣品(如蛋白質(zhì)、脂質(zhì)和氨基酸)中功能基團的基本振動,僅需要幾微升的小樣本量,即可提供快速的結(jié)果;同時也是一種節(jié)約成本、易于使用的診斷方法。ATR-FTIR技術(shù)進行血清分析已用于許多疾病研究,如癌癥、子宮內(nèi)膜異位癥、腦部疾病和病毒感染1~6。
水對生物液體測試的影響
ATR-FTIR技術(shù)在進行生物液體樣品分析時,水會對紅外光譜的產(chǎn)生影響,圖2。水的極性很強,會產(chǎn)生強烈的紅外響應(yīng);當使用ATR-FTIR分析生物流體樣品時,水的紅外光譜掩蓋了樣品中的生物信息。通常,在檢測生物液體時,測試者必須等待樣品干燥;這很耗時,并延長了總測試時間。更快的方法是使用加熱ATR附件。通過加熱樣品,水分蒸發(fā)得更快,總測試時間顯著減少。本文使用加熱ATR附件的IR5紅外光譜儀,去除水分并快速測量血清樣本的光譜。

圖2 紅外光譜中的水峰
實驗設(shè)備及方法
配有加熱ATR附件的愛丁堡IR5傅里葉變換紅外光譜儀,測量人類血清白蛋白樣本。ATR的反射晶體選擇金剛石材質(zhì)(高折射率和耐用性)。由于其優(yōu)異的導(dǎo)熱性,金剛石ATR附件適合于加熱實驗。

圖3 IR5傅里葉變換紅外光譜儀(a)和ATR加熱附件(b)
為了驗證加熱ATR附件對干燥時間的影響,將3μL樣品移液到ATR上,不加熱ATR采集光譜。ATR預(yù)熱并保持在50℃恒定,重復(fù)此過程。紅外光譜的分辨率設(shè)置為4cm-1,掃描10次,每個光譜的總測試時間為35秒。
結(jié)果與討論
人血清白蛋白在室溫下干燥2分鐘(藍色)和ATR加熱(紅色)的紅外光譜,如圖4所示。在室溫ATR測量中,光譜以水的吸收峰為主,生物光譜信息被覆蓋。使用加熱ATR可獲得無水干擾的完整生物光譜。如果將藍色光譜樣品在室溫下干燥,需要超過15分鐘的干燥時間,生物光譜才能充分顯示,這大大降低了測量通量。

圖4 人類血清白蛋白的ATR-FTIR光譜圖
(藍色:室溫下干燥2分鐘;紅色:加熱至50℃干燥)
ATR-FTIR提供了生物液體樣品中生物成分的重要信息,圖5給出了血清樣本光譜的波段分布。紅外生物光譜分布在兩個區(qū)域:從2600cm-1到3800cm-1的高波數(shù)區(qū)域,以及由雙鍵拉伸和指紋區(qū)組成的2000cm-1到500cm-1的低波數(shù)區(qū)域。低波數(shù)區(qū)域提供具鑒別性的數(shù)據(jù),也是最常用于診斷的區(qū)域7。

圖5 人類血清白蛋白的紅外光譜波段分布
結(jié)論
本文通過血清樣本的生物指紋圖譜測試,表明IR5對生物液體分析的高靈敏度。IR5傅里葉變換紅外光譜儀配備加熱ATR附件,克服了樣品含水的問題。使用加熱ATR附件,在不降低光譜質(zhì)量的情況下,使光譜采集所需的干燥時間大大縮短。

參考文獻
1.T. Soares Martins et al., “Potential of FTIR Spectroscopy Applied to Exosomes for Alzheimer’s Disease Discrimination: A Pilot Study,” J. Alzheimer’s Dis., vol. 74, no. 1, pp. 391–405, 2020.
2.L. J. Pabico et al., “Diagnostic Efficiency of Serum-Based Infrared Spectroscopy in Detecting Breast Cancer: A Meta-Analysis,” Lab. Med., vol. 54, no. 1, pp. 98–105, 2023.
3.S. Guo et al., “Fast and Deep Diagnosis Using Blood-Based ATR-FTIR Spectroscopy for Digestive Tract Cancers,” Biomolecules, vol. 12, no. 12, pp. 1–15, 2022.
4.S. Roy et al., “Spectroscopy goes viral: Diagnosis of hepatitis B and C virus infection from human sera using ATR-FTIR spectroscopy,” Clin. Spectrosc., vol. 1, p. 100001, 2019.
5.K. Naseer et al., “ATR-FTIR spectroscopy as the future of diagnostics: a systematic review of the approach using bio-fluids,” Appl. Spectrosc. Rev., vol. 56, no. 2, pp. 85–97, 2021.
6.I. Kokot et al., “ATR-IR Spectroscopy Application to Diagnostic Screening of Advanced Endometriosis,” Oxid. Med. Cell. Longev., vol. 2022, 2022.
7.A. Rohman et al., “The use of FTIR and Raman spectroscopy in combination with chemometrics for analysis of biomolecules in biomedical fluids: A review,” Biomed. Spectrosc. Imaging, vol. 8, no. 3–4, pp. 55–71, 2019.
天美分析更多資訊





































