Nature Materials | 南京郵電大學汪聯輝/高宇/晁潔 智能DNA納米器件,精確溶栓!
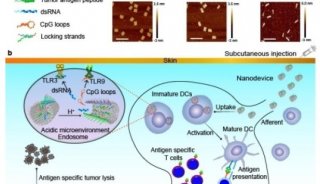
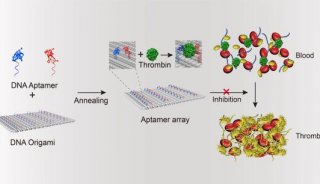
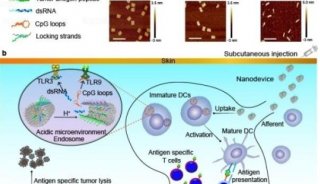
南京郵電大學汪聯輝、高宇及晁潔共同通訊在Nature Materials在線發表題為“An intelligent DNA nanodevice for precision thrombolysis”的研究論文,該研究描述了一種使用智能DNA納米器件精確遞送和精確給藥組織纖溶酶原激活劑(tPA)的方法。該研究使用DNA折紙將DNA納米片與預先設計的tPA結合位點和凝血酶反應DNA固定物整合在一起。該緊固件是一種互鎖DNA三重結構,可作為凝血酶識別器、閾值控制器和打開開關。
當裝載tPA并在體內靜脈給藥時,這些DNA納米裝置快速靶向血栓形成部位,跟蹤循環的微栓子,并僅在凝血酶濃度超過閾值時暴露活性tPA。在缺血性卒中和肺栓塞模型中證明了它們改善的治療效果,支持這些納米裝置為治療不同血栓提供準確的tPA劑量的潛力。

靜脈給藥組織纖溶酶原激活劑(tPA)仍然是臨床上缺血性卒中、肺栓塞(PE)和其他血栓相關疾病的金標準治療方法。遺憾的是,由于tPA存在出血并發癥風險高、循環半衰期短、靶向能力差等缺點,只有有限比例的患者(即不到7%的缺血性卒中患者)從溶栓治療中受益。將tPA精確地遞送到血栓形成部位,并按需釋放tPA,以減少脫靶和過量效應,仍然是溶栓治療的主要障礙。
在臨床前模型中,納米載體已被證明可以維持tPA的活性并延長其循環時間。血栓靶向遞送通過靶向配體或磁場提高血栓形成部位tPA的濃度。利用一系列外源性或內源性刺激,包括磁場、超聲波、剪切應力、H2O2等,觸發tPA從納米載體中釋放。盡管在這一領域已經取得了努力和進展,但在動物模型中已經證明了溶栓的適度結果,部分原因是納米載體的結構異質性和溶栓劑的負載不明確,導致生物分布和藥代動力學不受控制。
此外,由于參與不同生理過程的血栓生物標志物(如凝血酶或纖維蛋白)的動態濃度,目前的策略存在遞送準確性差的問題。理想的納米載體不僅要靶向而且要識別生物標志物的局部濃度,從而在確定血栓形成部位的情況下觸發tPA的釋放。因此,通過納米載體精確控制tPA的裝載、遞送和釋放,也被稱為tPA的精確給藥,是極具挑戰性的。

tPA-DNA納米器件的設計與表征(Credit:?Nature Materials)
最近開發的一種方法是合理設計和制造結構明確的DNA納米結構作為藥物遞送平臺,對藥物分子和功能部分進行化學計量和空間控制的整合。在DNA折紙納米技術的基礎上,可以構建具有均勻形狀和尺寸的DNA納米結構。定義良好且高度可尋址的DNA納米結構允許藥物分子和功能部分(包括靶向配體和刺激反應部分)以精確控制的數量和位置進行整合。利用這一策略,DNA納米結構已經被開發出來,并用于腫瘤靶向和抗癌藥物和疫苗的刺激應答遞送。體內溶栓治療的DNA納米結構可能是精確給藥的最佳方案,但尚未被描述。考慮到生物標志物的動態濃度和患者的異質性,一個可調的閾值控制器可以區分正常凝血和血栓,通過邏輯操作觸發tPA的釋放是非常有意義的。
該研究已經開發了一種DNA納米裝置,可以精確地給藥tPA,用于精確的溶栓治療。可編程的DNA納米裝置能夠定位和準確地裝載藥物分子,選擇性地跟蹤和靶向血栓形成或循環微栓子的位置,并根據凝血酶濃度按需釋放溶栓藥物,從而改善藥物的治療效果的同時盡量減少副作用。調整DNA納米器件的凝血酶反應范圍(即閾值濃度)的能力提供了tPA劑量治療不同血栓的準確性。鑒于溶栓藥物對血栓形成的精確遞送的重要性,該研究提出了基于血栓形成部位的生物標志物,通過集成多個邏輯門來開發下一代智能DNA納米器件的方法,進一步提高溶栓藥物的遞送精度和安全性,同時不影響其溶栓效果。
版權聲明 本網站所有注明“來源:生物谷”或“來源:bioon”的文字、圖片和音視頻資料,版權均屬于生物谷網站所有。非經授權,任何媒體、網站或個人不得轉載,否則將追究法律責任。取得書面授權轉載時,須注明“來源:生物谷”。其它來源的文章系轉載文章,本網所有轉載文章系出于傳遞更多信息之目的,轉載內容不代表本站立場。不希望被轉載的媒體或個人可與我們聯系,我們將立即進行刪除處理。
-
科技前沿

-
技術原理
-
項目成果
-
項目成果
-
項目成果